摘要:研究人員開(kāi)展了關(guān)于S-亞硝基化修飾EZH2的研究。
在生命的微觀世界里,細(xì)胞的正常運(yùn)作依賴于各種精細(xì)的調(diào)控機(jī)制。一氧化氮(NO)作為一種多功能的生物活性分子,在細(xì)胞功能調(diào)節(jié)中扮演著重要角色,它可通過(guò)S-亞硝基化修飾蛋白質(zhì)來(lái)發(fā)揮作用。EZH2是多梳抑制復(fù)合物2(PRC2)的關(guān)鍵功能性酶組分,負(fù)責(zé)催化組蛋白H3第27位賴氨酸的甲基化(H3K27me3),進(jìn)而調(diào)控基因表達(dá),在細(xì)胞分化、發(fā)育以及多種疾病進(jìn)程中都有著舉足輕重的地位。此前,雖然NO信號(hào)通路對(duì)血管內(nèi)皮細(xì)胞基因表達(dá)有影響,但NO依賴的蛋白質(zhì)S-亞硝基化修飾在定義內(nèi)皮細(xì)胞表觀遺傳景觀中的作用尚不明確,EZH2的S-亞硝基化修飾及其對(duì)該關(guān)鍵表觀遺傳調(diào)節(jié)因子的催化活性、定位和降解的影響也未見(jiàn)報(bào)道。為了填補(bǔ)這些知識(shí)空白,來(lái)自印度比拉理工學(xué)院(Birla Institute of Technology and Science)的研究人員開(kāi)展了深入研究,相關(guān)成果發(fā)表在《Nature Communications》上,為理解內(nèi)皮細(xì)胞功能調(diào)控及相關(guān)疾病治療提供了新的視角。
研究人員主要運(yùn)用了以下幾種關(guān)鍵技術(shù)方法:一是使用生物素開(kāi)關(guān)法(biotin switch assay)和碘代串聯(lián)質(zhì)譜標(biāo)簽(iodoTMT)標(biāo)記試劑檢測(cè)EZH2的S-亞硝基化;二是通過(guò)免疫共沉淀(co-immunoprecipitation)實(shí)驗(yàn)探究蛋白質(zhì)之間的相互作用;三是利用染色質(zhì)免疫沉淀(Chromatin Immunoprecipitation,ChIP)及后續(xù)的定量PCR分析基因啟動(dòng)子區(qū)域H3K27me3的富集情況;四是借助分子動(dòng)力學(xué)(MD)模擬從結(jié)構(gòu)層面分析S-亞硝基化對(duì)EZH2-SUZ12復(fù)合物的影響。
 圖1EZH2的S-亞硝基化通過(guò)改變PRC2復(fù)合物的組裝、甲基轉(zhuǎn)移酶活性及EZH2的穩(wěn)定性來(lái)維持內(nèi)皮穩(wěn)態(tài)
圖1EZH2的S-亞硝基化通過(guò)改變PRC2復(fù)合物的組裝、甲基轉(zhuǎn)移酶活性及EZH2的穩(wěn)定性來(lái)維持內(nèi)皮穩(wěn)態(tài)SNP/GSNO與EZH2的相互作用及對(duì)相關(guān)指標(biāo)的影響
研究人員以硝普鈉(SNP)作為外源性NO供體,發(fā)現(xiàn)SNP處理人臍靜脈內(nèi)皮細(xì)胞(HUVEC)和人臍靜脈內(nèi)皮細(xì)胞系(EA.hy926細(xì)胞)后,細(xì)胞內(nèi)亞硝酸鹽水平呈時(shí)間依賴性增加。SNP可使EZH2蛋白及其催化產(chǎn)物H3K27me3水平降低,且H3K27me3水平在SNP處理1小時(shí)后就顯著下降,早于EZH2蛋白在2小時(shí)后的降解。進(jìn)一步研究表明,SNP處理30分鐘時(shí),SUZ12就從EZH2結(jié)合的PRC2復(fù)合物上解離,導(dǎo)致PRC2復(fù)合物催化活性降低。同時(shí),SNP促使EZH2發(fā)生胞質(zhì)轉(zhuǎn)位,通過(guò)亞細(xì)胞分級(jí)分離和免疫熒光實(shí)驗(yàn)得以證實(shí)。為排除SNP作用的非特異性,研究人員使用S-亞硝基谷胱甘肽(GSNO)進(jìn)行實(shí)驗(yàn),得到了相似的結(jié)果,且GSNO處理后EZH2的相互作用蛋白發(fā)生改變,通過(guò)質(zhì)譜分析鑒定出了相關(guān)變化的蛋白。
EZH2的S-亞硝基化修飾及對(duì)PRC2復(fù)合物活性的影響
研究人員通過(guò)體外無(wú)細(xì)胞系統(tǒng)和細(xì)胞實(shí)驗(yàn)證實(shí),NO處理可使EZH2蛋白發(fā)生S-亞硝基化修飾。生物素開(kāi)關(guān)法和免疫沉淀實(shí)驗(yàn)表明,在EA.hy926細(xì)胞中,NO處理后EZH2蛋白被S-亞硝基化。同時(shí),使用天然誘導(dǎo)劑緩激肽(bradykinin)誘導(dǎo)內(nèi)源性NO產(chǎn)生,也檢測(cè)到EZH2蛋白的S-亞硝基化及與SUZ12結(jié)合的喪失。此外,H3K27me3組蛋白甲基轉(zhuǎn)移酶(HMT)活性測(cè)定顯示,SNP或GSNO處理后,PRC2復(fù)合物的甲基轉(zhuǎn)移酶活性顯著降低,說(shuō)明EZH2的S-亞硝基化導(dǎo)致SUZ12從PRC2復(fù)合物上早期解離,進(jìn)而降低其催化活性。
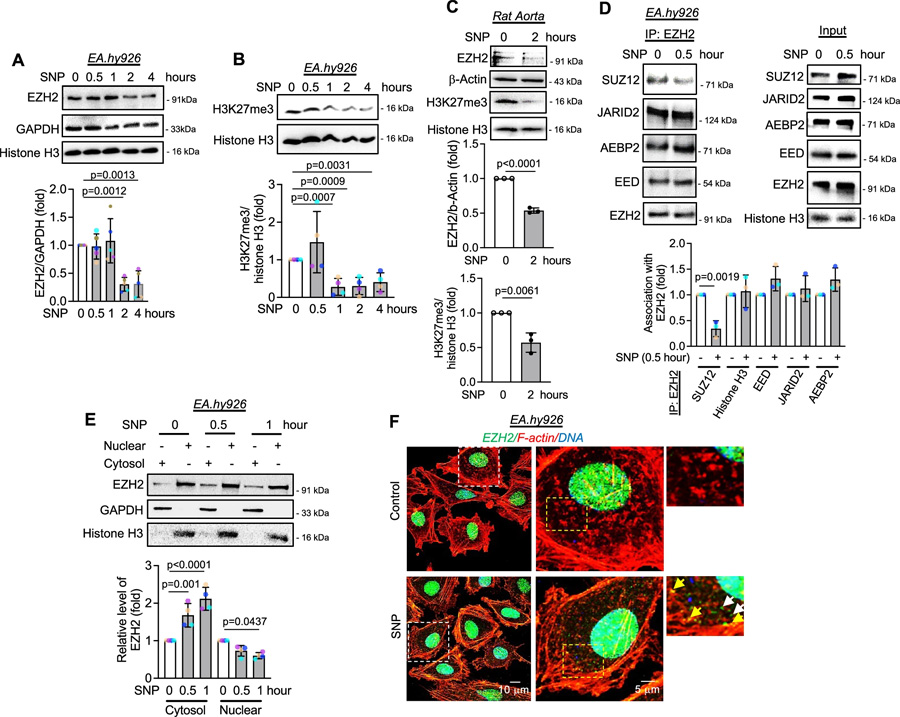 圖2一氧化氮通過(guò)誘導(dǎo)SUZ12解離,引發(fā)EZH2蛋白的胞質(zhì)定位與降解,并伴隨H3K27me3水平的早期下降
圖2一氧化氮通過(guò)誘導(dǎo)SUZ12解離,引發(fā)EZH2蛋白的胞質(zhì)定位與降解,并伴隨H3K27me3水平的早期下降EZH2降解途徑及內(nèi)源性NO抑制的影響
研究發(fā)現(xiàn),S-亞硝基化的EZH2主要通過(guò)自噬溶酶體途徑降解。使用蛋白酶體抑制劑MG132不能逆轉(zhuǎn)SNP處理后EZH2的降解,而自噬溶酶體途徑抑制劑巴弗洛霉素A1(bafilomycin A1)可部分逆轉(zhuǎn)。同時(shí)抑制蛋白酶體和自噬溶酶體途徑,能完全逆轉(zhuǎn)EZH2的降解,但無(wú)法恢復(fù)H3K27me3的水平。此外,抑制內(nèi)源性NO產(chǎn)生機(jī)制,如使用eNOSsiRNA敲低HUVEC細(xì)胞中的eNOS,或用L-NAME抑制一氧化氮合酶(NOS),可逆轉(zhuǎn)由VEGF或緩激肽誘導(dǎo)的EZH2和H3K27me3水平的降低,且限制EZH2的胞質(zhì)轉(zhuǎn)位,使其定位在細(xì)胞核中。
EZH2-H3K27me3軸在糖尿病腎病中的作用及調(diào)節(jié)效果
研究人員發(fā)現(xiàn),在糖尿病腎病中,EZH2-H3K27me3軸增強(qiáng)。預(yù)先用H3K27me3特異性去甲基化酶抑制劑GSK-J4處理細(xì)胞,可逆轉(zhuǎn)SNP誘導(dǎo)的H3K27me3水平降低,并抑制SNP誘導(dǎo)的內(nèi)皮細(xì)胞遷移。通過(guò)實(shí)時(shí)定量PCR(qPCR)和染色質(zhì)免疫沉淀實(shí)驗(yàn)發(fā)現(xiàn),SNP處理后,與內(nèi)皮功能相關(guān)的基因如VEGFa、TBX20等的轉(zhuǎn)錄水平增加,且這些基因啟動(dòng)子區(qū)域H3K27me3的富集減少。在高糖環(huán)境下,GSNO處理可逆轉(zhuǎn)高糖誘導(dǎo)的EC和大鼠主動(dòng)脈中EZH2、H3K27me3水平的升高以及炎癥黏附分子ICAM1的表達(dá),減少單核細(xì)胞黏附,這表明S-亞硝基化介導(dǎo)的EZH2調(diào)節(jié)可能是對(duì)抗糖尿病血管并發(fā)癥的潛在治療策略。
EZH2特定半胱氨酸殘基S-亞硝基化的作用及分子機(jī)制
通過(guò)預(yù)測(cè)工具發(fā)現(xiàn)EZH2蛋白的半胱氨酸329(C329)、700(C700)等位點(diǎn)可能發(fā)生S-亞硝基化。構(gòu)建點(diǎn)突變體實(shí)驗(yàn)表明,C329S突變體對(duì)SNP處理不敏感,其EZH2蛋白水平未受影響,但H3K27me3水平顯著降低;C700S突變體的EZH2蛋白水平在SNP處理后顯著下降,而H3K27me3水平不變。雙突變體EZH2 C329S C700S對(duì)SNP完全不敏感。免疫熒光和共聚焦成像顯示,SNP可誘導(dǎo)野生型EZH2的胞質(zhì)轉(zhuǎn)位,但對(duì)C329S和雙突變體無(wú)此作用。分子動(dòng)力學(xué)模擬顯示,EZH2在C329和C700位點(diǎn)的S-亞硝基化導(dǎo)致EZH2-SUZ12復(fù)合物構(gòu)象改變,使SUZ12與EZH2的SAL結(jié)構(gòu)域結(jié)合減弱,最終導(dǎo)致復(fù)合物不穩(wěn)定。
綜上所述,該研究揭示了NO信號(hào)通路通過(guò)S-亞硝基化修飾EZH2的C329和C700殘基,影響PRC2復(fù)合物的穩(wěn)定性和催化活性,進(jìn)而調(diào)控基因表達(dá),維持內(nèi)皮穩(wěn)態(tài)。在糖尿病等疾病狀態(tài)下,S-亞硝基化修飾EZH2可能成為潛在的治療靶點(diǎn)。不過(guò),研究也存在一定局限性,如未能在體內(nèi)模型中證實(shí)eNOS基因表達(dá)或催化抑制對(duì)EZH2和H3K27me3的影響。未來(lái)研究可進(jìn)一步探索NO依賴的表觀遺傳通路調(diào)控機(jī)制,為相關(guān)疾病的治療提供更堅(jiān)實(shí)的理論基礎(chǔ)和潛在的治療策略。
參考資料
[1]S-nitrosylation of EZH2 alters PRC2 assembly, methyltransferase activity, and EZH2 stability to maintain endothelial homeostasis
 圖1EZH2的S-亞硝基化通過(guò)改變PRC2復(fù)合物的組裝、甲基轉(zhuǎn)移酶活性及EZH2的穩(wěn)定性來(lái)維持內(nèi)皮穩(wěn)態(tài)
圖1EZH2的S-亞硝基化通過(guò)改變PRC2復(fù)合物的組裝、甲基轉(zhuǎn)移酶活性及EZH2的穩(wěn)定性來(lái)維持內(nèi)皮穩(wěn)態(tài)















