摘要:本研究深入探討了細(xì)胞外囊泡(EVs)在乳腺癌(BC)轉(zhuǎn)移前微環(huán)境(PMN)形成中的關(guān)鍵作用。
乳腺癌轉(zhuǎn)移的"特洛伊木馬":細(xì)胞外囊泡的致病機(jī)制與治療前景
乳腺癌是全球女性健康的重要威脅,其復(fù)雜的轉(zhuǎn)移過程導(dǎo)致患者預(yù)后不良。近年研究發(fā)現(xiàn),細(xì)胞外囊泡(EVs)作為腫瘤微環(huán)境(TME)中的關(guān)鍵信使,通過"特洛伊木馬"機(jī)制在乳腺癌轉(zhuǎn)移中發(fā)揮核心作用。
 圖1 細(xì)胞外囊泡:乳腺癌宿主微環(huán)境中的“特洛伊木馬”
圖1 細(xì)胞外囊泡:乳腺癌宿主微環(huán)境中的“特洛伊木馬”轉(zhuǎn)移前微環(huán)境的建立
轉(zhuǎn)移前微環(huán)境(PMN)是癌細(xì)胞遠(yuǎn)端轉(zhuǎn)移的"土壤"。乳腺癌細(xì)胞通過分泌EVs重塑靶器官微環(huán)境,其中:
骨轉(zhuǎn)移:MDAMB-231細(xì)胞來源的EVs攜帶miR-21抑制PDCD4表達(dá),激活NFATc1信號(hào)促進(jìn)破骨細(xì)胞分化
肺轉(zhuǎn)移:Lin28B高表達(dá)的EVs降低let-7水平,誘導(dǎo)中性粒細(xì)胞N2極化,形成免疫抑制微環(huán)境
腦轉(zhuǎn)移:CEMIP陽性的EVs通過Ptgs2/TNF/CCL/CXCL等因子促進(jìn)血腦屏障破壞
肝轉(zhuǎn)移:ITGv5陽性EVs激活肝竇內(nèi)皮細(xì)胞(LSECs),上調(diào)S100蛋白促進(jìn)炎癥反應(yīng)
EVs介導(dǎo)的耐藥機(jī)制
化療藥物可 paradoxically 促進(jìn)EVs分泌:
赫賽汀耐藥:EVs傳遞miR-567抑制ATG5表達(dá),阻斷自噬過程
激素治療耐藥:EVs傳遞宿主線粒體DNA(mtDNA)增強(qiáng)氧化磷酸化(OXPHOS)
紫杉醇耐藥:EVs攜帶miR-9-5p/miR-159-5p/miR-203a-3p抑制ONECUT2,促進(jìn)腫瘤干細(xì)胞(CSCs)轉(zhuǎn)化
代謝重編程與血管生成
EVs通過獨(dú)特機(jī)制調(diào)控腫瘤代謝:
miR-122抑制胰腺β細(xì)胞丙酮酸激酶(PK),創(chuàng)造高血糖PMN
HISLA lncRNA競爭性結(jié)合PHD2,穩(wěn)定HIF-1α促進(jìn)有氧糖酵解
EPHA2陽性EVs激活A(yù)MPK信號(hào),circRNA-HIPK3/miR-124-3p/MTDH軸促進(jìn)血管新生
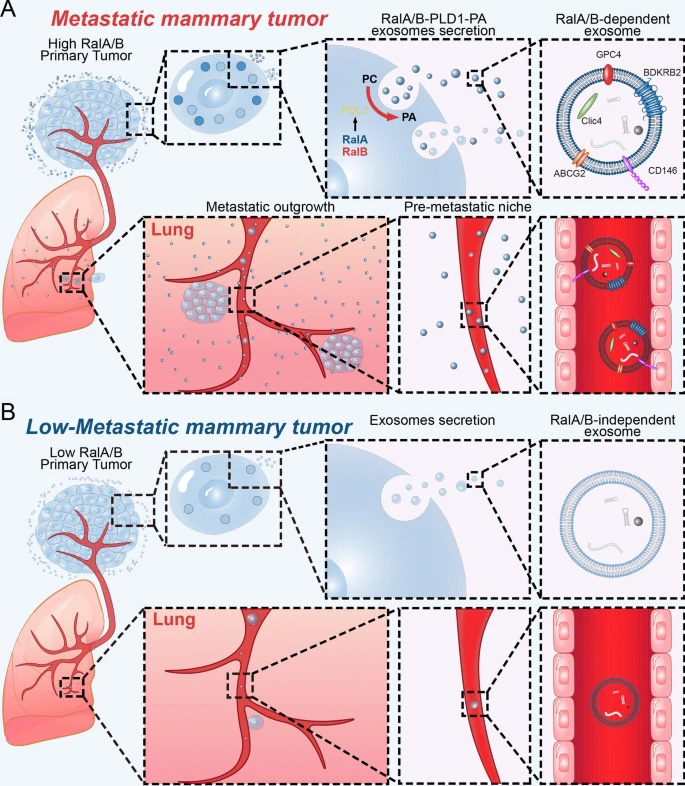
圖2 來自RalA或RalB缺陷細(xì)胞的外泌體具有較弱的器官靶向能力
EVs治療策略的創(chuàng)新應(yīng)用
基于EVs的靶向治療展現(xiàn)巨大潛力:
抗血管生成:AS1411適配體修飾的DCs-EVs共遞送let-7/si-VEGF
免疫調(diào)節(jié):M1巨噬細(xì)胞來源的DOX-M1-Exos重編程M2-TAMs
工程化EVs:aCD3-aHER2 SMART-Exosomes橋接T細(xì)胞與腫瘤細(xì)胞
仿生納米囊泡:aMT-exos激活CCL19/CXCL9等免疫刺激通路
挑戰(zhàn)與展望
盡管EVs研究取得突破,仍面臨:
分離純化方法標(biāo)準(zhǔn)化難題
大規(guī)模生產(chǎn)的技術(shù)瓶頸
脂質(zhì)組學(xué)研究相對(duì)滯后
臨床轉(zhuǎn)化路徑尚待明確
未來需通過多組學(xué)整合和納米工程技術(shù)創(chuàng)新,推動(dòng)EVs從基礎(chǔ)研究向臨床應(yīng)用的轉(zhuǎn)化,為乳腺癌治療提供新的突破點(diǎn)。
參考資料
[1] Extracellular vesicles: the "Trojan Horse" within breast cancer host microenvironments
 蛋白酶K (源自林伯氏白色念球菌)
蛋白酶K (源自林伯氏白色念球菌) 茚三酮顯色溶液套裝,日立分析儀專用 (299-70501)
茚三酮顯色溶液套裝,日立分析儀專用 (299-70501) 氨基酸混合標(biāo)準(zhǔn)溶液,AN-2型 (011-14463)
氨基酸混合標(biāo)準(zhǔn)溶液,AN-2型 (011-14463) 表面潤濕張力試驗(yàn)用混合液 Wetting Tension Test Mixture
表面潤濕張力試驗(yàn)用混合液 Wetting Tension Test Mixture