摘要:先進的顯微鏡技術,讓科學家們知道如何對抗一種導致全球抗生素耐藥性細菌感染病例增加的酶。
細菌從武器庫中汲取武器,以對抗旨在殺死它們的藥物。這些武器中最普遍的是核糖體修飾酶。這些酶正變得越來越普遍,出現在世界范圍內一系列耐藥細菌的臨床樣本中。
現在,科學家們已經捕捉到了一類重要的酶的第一張圖像。這些圖像顯示了酶是如何鎖定在細菌核糖體上的一個特定位置,并像鑷子一樣擠壓它,以提取RNA核苷酸并改變它。美國國家科學院院刊(PNAS)發表了由埃默里大學的科學家領導的研究結果。
 圖1 酶是如何鎖定在細菌核糖體上的一個特定位置
圖1 酶是如何鎖定在細菌核糖體上的一個特定位置先進的低溫電子顯微鏡技術使超高分辨率的三維快照成為可能。
“眼見為實,”埃默里大學化學教授、該論文的共同通訊作者克里斯汀·鄧納姆(Christine Dunham)說。“當你在現實生活中看到生物結構在原子水平上相互作用的那一刻,就像在玩拼圖游戲。你會看到每件事是如何結合在一起的,你會更清楚地知道事情是如何運作的。”
這些見解可能會導致設計新的抗生素療法來抑制RNA甲基轉移酶的耐藥活性。這些酶將一種被稱為甲基的小碳氫化合物從一個分子轉移到另一個分子,這一過程被稱為甲基化。
“甲基化是生物學中最小的化學修飾之一,”埃默里醫學院生物化學教授、該論文的共同通訊作者格雷姆·康恩(Graeme Conn)說。“但這種微小的改變可以從根本上改變生物學。在這種情況下,它賦予細菌抵抗力,使其能夠逃避一整類抗生素。”
康恩和鄧納姆也是埃默里抗生素耐藥性中心的成員。
這篇論文的第一作者是Pooja Srinivas,他是埃默里大學分子和系統藥理學研究生項目的博士候選人。后來她畢業了,現在是華盛頓大學的博士后。
鄧納姆是研究核糖體的權威專家。核糖體是一種復雜的結構,像細胞內的工廠一樣運作,制造蛋白質。蛋白質是使細胞運轉的機器,而DNA和RNA等核酸則儲存著生命的藍圖。核糖體主要由RNA構成,RNA不僅儲存信息,還可以作為酶,催化化學反應。
鄧納姆實驗室的一個目標是找到操縱細菌核糖體的方法,使它們對抗菌劑更敏感。如果一種抗菌劑成功地使細菌核糖體失活,就會停止制造細菌生長和生存所必需的蛋白質。
這個想法是利用人類細胞核糖體和細菌核糖體的差異,這樣只有細菌才能被抗菌藥物靶向。
然而,抗菌劑需要通過細菌防御。
“這就像一場分子軍備競賽,”鄧納姆解釋說。細菌不斷進化出新的武器來抵御藥物,而科學家們也不斷進化出新的策略來解除細菌的武裝。
Conn是細菌防御武器核糖體RNA甲基轉移酶方面的領先專家。這個酶家族最初是在土壤細菌中發現的。它們現在越來越多地出現在人類和動物的細菌感染中,使這些感染更難治療。
“它們在世界不同地區的一些令人討厭的細菌病原體的臨床樣本中越來越頻繁地出現,”Conn說。
這些酶可以使大腸桿菌、沙門氏菌、肺炎克雷伯菌、銅綠假單胞菌和腸桿菌科等病原體產生致命的耐藥性。這種酶在細菌核糖體的特定位置添加一個甲基。這種添加物阻斷了氨基糖苷類抗生素結合并產生抗菌作用的能力。
在《美國國家科學院院刊》的論文中,研究人員關注的是核糖體RNA甲基轉移酶C (RmtC)家族中的罪魁禍首。
幾十年來,研究人員一直依靠一種被稱為x射線晶體學的技術來揭示分子機器在分子排列成晶體時如何工作的原子細節。
例如,2015年,鄧納姆的實驗室通過x射線晶體學獲得了一種名為HigB的酶如何撕裂RNA以抑制細菌生長的精確圖像。通過抑制制造它的細菌的生長,HigB建立了一種休眠的“持久性細胞”狀態,使細菌對抗生素產生耐受性。
研究人員的下一個任務是證明采用最佳遞送策略的治療方法也適用于帶有特定基因融合的白血病小鼠。
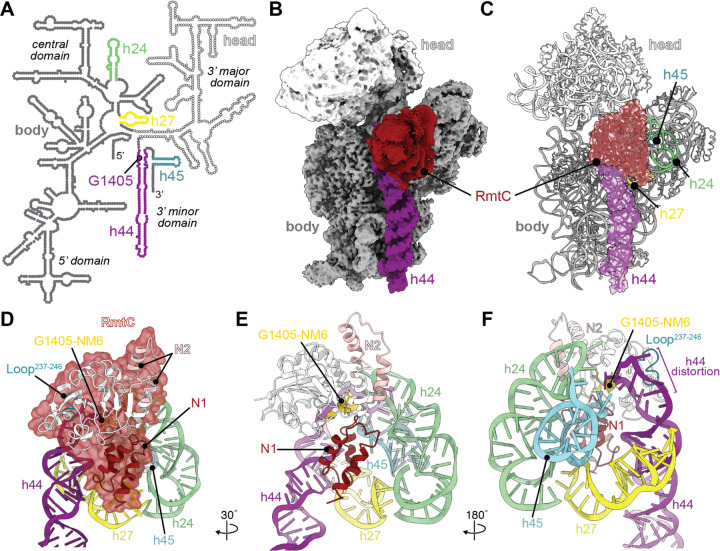 RmtC與保護性16S rRNA三維表面結合。
RmtC與保護性16S rRNA三維表面結合。然而,RmtC酶如何與核糖體相互作用的秘密卻無法通過x射線晶體學得到。
“RmtC要復雜得多,”鄧納姆解釋說。“從基礎科學的角度來看,這是一種有趣的酶,因為它看起來與其他酶非常不同。”
低溫電子顯微鏡的最新進展為放大RmtC的復雜機制打開了大門。
低溫電子顯微鏡不需要結晶來揭示分子的結構和它們如何相互作用。相反,液體樣品被迅速冷凍以形成玻璃狀基質。玻璃狀基質保留了分子的三維結構,并保護它們免受強電子束的破壞。
Meisam Nosrati是康涅狄格州實驗室的前博士后研究員,也是PNAS論文的合著者,他制備了RmtC與大腸桿菌核糖體部分相互作用的樣品。他利用了合著者林賽·科姆斯托克(Lindsay Comstock)的專業知識。科姆斯托克是維克森林大學(Wake Forest University)的化學家,他開發了一種技術,可以將酶捕獲并穩定在所需的位置上。
然后,Nosrati將樣品冷凍在一個小網格上,并將它們送到太平洋西北中心進行低溫電子顯微鏡成像。
作為鄧納姆實驗室的研究生,Pooja Srinivas隨后分析和解釋了顯微鏡數據集。她使用計算機算法將數千張單獨的圖像拼接在一起。結果將這些圖像變成了一本展示RmtC復雜結構的翻頁書。
“這種酶就像鉗子一樣鎖在核糖體上,”鄧納姆解釋說。“它會收緊控制,直到從RNA螺旋的內部擠出一個核苷酸。然后對核苷酸進行化學修飾。”
這種酶在與核糖體結合的位置上非常精確,核糖體是一種由50種不同的蛋白質和6000種不同的RNA核苷酸組成的大分子。
研究人員使用生物化學技術驗證了他們的觀察結果與先前的發現相吻合,即RmtC如何使細菌對靶向核糖體的氨基糖苷類抗菌劑產生耐藥性。
研究人員現在正試圖開發新的方法來對抗RmtC和相關酶的影響。
康恩說:“了解酶在進行化學反應時的形狀,為我們提供了抑制其作用的新目標。”“例如,我們可以瞄準酶的鉗形作用,試圖阻止它擠壓和結合到核糖體上。我們現在知道,這種酶在其表面形成一個口袋,小分子可能會在那里阻止這種作用。”
PNAS論文的其他共同作者是康涅狄格州實驗室的研究科學家Natalia Zelinskaya和Debayan Dey。
這項工作的資金由美國國立衛生研究院和傳染病發病機制Burroughs Wellcome基金研究員獎提供。
[1] 360 subunit recognition and G1405 modification by the aminoglycoside-resistance 16S riobsomal RNA methltransferase RmtC
















