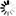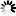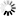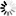Nature子刊和Aging Cell兩篇論文:線粒體功能障礙是如何導致早衰和疾病的
摘要:布法羅大學(University at Buffalo)的研究人員及其合作者已經開發出強大的新方法,來研究并可能逆轉導致線粒體疾病和過早衰老的細胞機制。
布法羅大學的研究人員和他們的合作者已經開發出強大的新方法來研究并可能逆轉導致線粒體疾病和過早衰老的細胞機制。
線粒體提供了細胞正常運作所需的大部分能量,所以線粒體的基因缺陷可能會導致嚴重的疾病,如果不及早發現和治療,這些疾病可能是毀滅性的。
但是這些線粒體缺陷究竟是如何導致疾病和衰老的還沒有被很好地理解。發表在《衰老細胞》雜志上的一篇論文首次揭示了衰老過程中線粒體缺陷和關鍵信號之間的聯系。在《自然通訊》雜志的另一篇論文中,研究人員描述了他們基于光遺傳學開發的一項新技術如何幫助異常的線粒體相互作用恢復正常功能。

圖1 早衰與高水平的8-氧代鳥嘌呤和DNA損傷增加正相關(圖源:[1])
線粒體和端粒
《衰老細胞》的論文首次將線粒體功能障礙與端粒縮短聯系起來,端粒縮短是早衰的關鍵生物標志物。
布法羅大學雅各布斯醫學和生物醫學科學學院兒科遺傳學系主任、醫學博士Taosheng Huang教授解釋說:“端粒是一種特殊的DNA序列,起到了穩定染色體末端的帽子的作用。”
“端粒縮短通常被認為是衰老的重要生物標志物,但長期以來,沒有人知道其機制。現在我們能夠將線粒體功能障礙與端粒縮短直接聯系起來,”該論文的資深作者黃說。
實驗是用一種名為Polg“mutator”的小鼠模型進行的,這種小鼠攜帶一種特定的基因缺陷,可以加速線粒體DNA突變的速度。
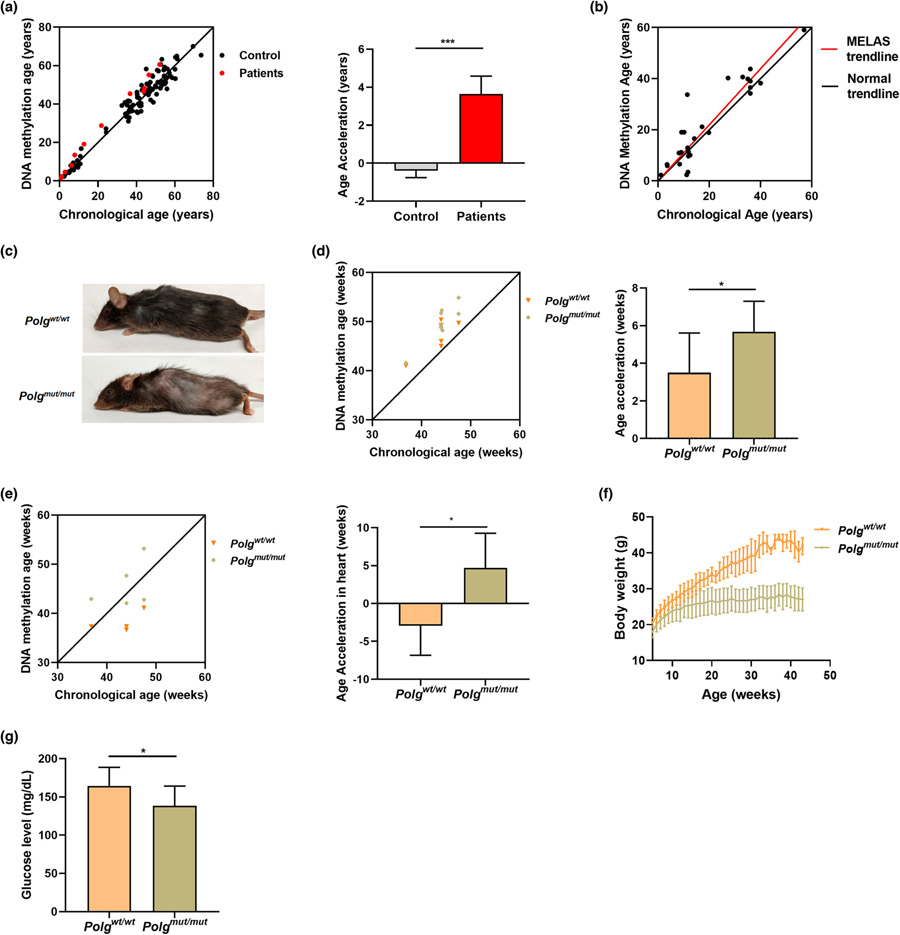
圖2 致病性線粒體DNA突變加速了衰老。
Taosheng Huang教授說:“我們還能夠在人類身上證明,線粒體DNA中一個核苷酸的變化是如何加速衰老的,這種變化與線粒體功能低下和導致兒童線粒體疾病有關。”“我們發現,隨著時間的推移,線粒體功能低下導致的活性氧會增加DNA損傷。”
這篇論文首次表明,在這個模型中,線粒體DNA突變會產生更快的衰老,正如DNA時鐘所顯示的那樣,它根據DNA中的特定化學標記來估計一個人的生物年齡。
這項研究是所有作者成功合作的結果,包括加州大學洛杉磯分校人類遺傳學和生物統計學教授Steve Horvath博士,他開發了DNA鐘,以及匹茲堡大學副教授Patricia Opresko博士和曼尼托巴大學的Sabine Mai博士,他們都是端粒和端粒損傷方面的專家。
這項研究是由國家環境與職業健康研究所和國家老齡化研究所資助的,這兩家機構都是國家健康研究所。
組織細胞間的相互作用
7月25日,《自然通訊》雜志發表了一篇論文,揭示了光遺傳學是如何利用光來操縱細胞活動的,它不僅可以被用作研究工具,還可以被用作實時協調細胞器相互作用的工具。

圖3 通過線粒體-溶酶體接觸的光遺傳學控制光激活線粒體分裂(圖源:[2])
這篇論文的重點是線粒體動力學,這些細胞器不斷經歷的過程,以保持細胞內的健康平衡。它們會發生裂變,一個線粒體分裂成兩個,以及融合,兩個線粒體融合成一個。細胞中這兩種過程之間的不平衡會導致線粒體疾病。
Taosheng Huang說,“在《自然通訊》的論文中,我們描述了一項我們開發的技術,該技術首次允許我們直接操縱線粒體和細胞中其他細胞器之間的相互作用”。
“通過利用光遺傳學迫使線粒體和另一細胞成分溶酶體之間產生物理作用,我們能夠恢復線粒體到更正常的大小,同時改善它們的能量生產功能,我們相信,這項新發現可以作為這類疾病未來診斷和治療的基礎。”
這項工作是由于使用了辛辛那提大學的一種強大的成像技術——結構照明顯微鏡(SIM)而得以實現的,黃在辛辛那提大學擔任現任研究員之前就開始了這項研究。SIM允許對活細胞進行極高分辨率的實時成像。
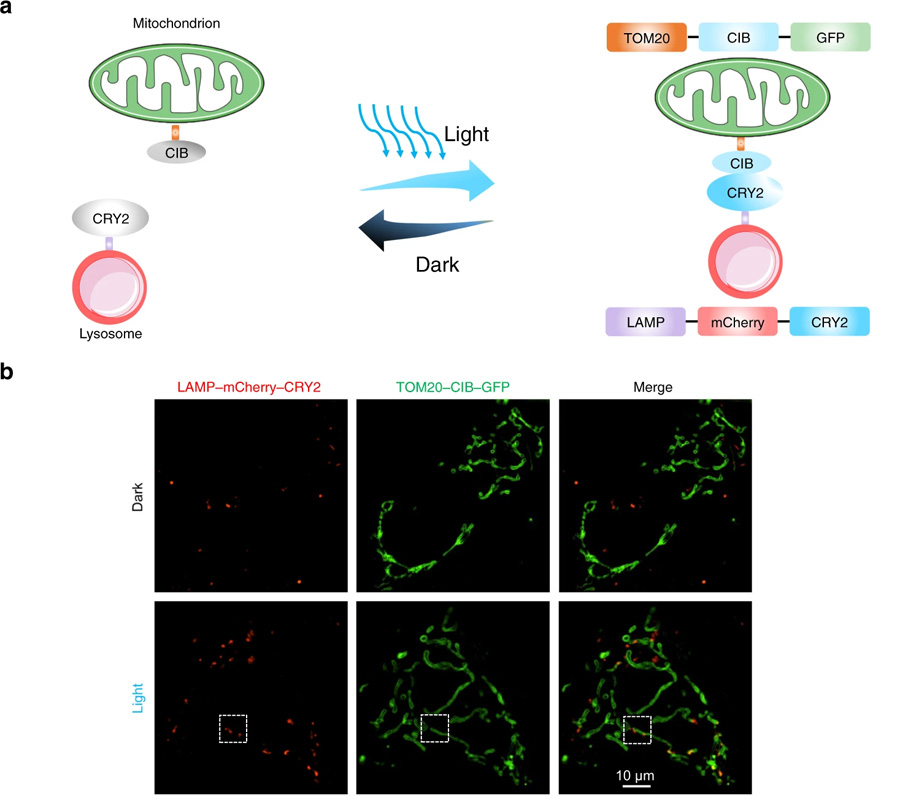
圖4 光遺傳學可用于誘導線粒體-溶酶體接觸(圖源:[2])
Taosheng Huang是一名線粒體疾病遺傳學方面的專家,在檢測和治療遺傳疾病方面開創了開創性的創新。他于2020年從辛辛那提兒童醫院醫療中心被招募到UB和John R. Oishei兒童醫院。他同時也是奧賽兒童醫院遺傳與代謝科的醫學主任,以及UBMD兒科的人類遺傳學主任。
《自然通訊》雜志這篇論文的共同作者來自辛辛那提大學醫學院、辛辛那提兒童醫院醫學中心和伊利諾伊大學厄巴納-香檳分校。這項研究由美國國立衛生研究院資助。
參考資料:
[1]Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
 |
 |
 |
| 官網:m.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
相關資訊
- Cell論文解讀!新方法首次詳細揭示核孔復合物的組裝過程
- Developmental Cell:為入侵細胞的“前線”提供燃料
- 羧甲基纖維素
- 使用Megazyme檢測試劑盒進行定量分析時,其精度和可重現性如何?
- “我和我的祖國” - 西寶生物獻禮祖國七十周年華誕
- 科學家發現一種罕見自身免疫疾病
- 抑郁癥會導致大腦損傷
- 西寶品牌商城閃亮登場
- 為何你的胳膊和腿上有毛發,而手掌和腳底上沒有毛發?
- 孩子最喜歡吃的彩虹糖可致DNA改變!傷害大腦、肝臟、腎臟……
新進產品
同類文章排行
- 清除人體內衣原體感染的關鍵鑰匙
- iScience:一種對抗遺傳性神經系統疾病的潛在途徑
- 真的有可以中和所有已知COVID-19毒株的抗體?
- 細胞“廢物”使抗癌的免疫細胞恢復活力!
- 男性注意!這種食品攝入過多會導致結直腸癌
- 無路可退!主食中的農藥殘留,可誘發阿爾茨海默病
- Cell出乎意料新發現:原來是這種“瀕死體驗”讓癌細胞惡化
- 研究發現,冠狀病毒的形狀會影響其傳播
- Science Advances新突破:快速高效生產人體免疫細胞的新方法
- 《Nature Genetics》確定10個克羅恩病相關基因
資訊文章
您的瀏覽歷史